Toutes les réactions chimiques ne comportent pas un gain ou une perte d’électrons. Les substances qui libèrent des ions hydrogène réagissent avec ceux qui les acceptent. C’est la base d’une réaction de neutralisation, et des réactions de ce type se produisent partout, à l’intérieur et à l’extérieur du laboratoire, du sol aux organes sexuels.
Imaginez les espèces acides, les releveurs H +, comme nourriture pour pac-men, qui sont les ions hydroxyde 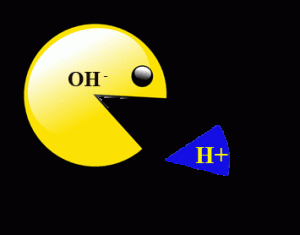 (OH-), les accepteurs H + communs. Pour qu’une réaction de neutralisation soit terminée, tous les pac-men doivent être nourris. Le pacman farci est une molécule d’eau. Cependant, la réalité est un peu plus complexe que l’analogie. Les pacmen et leurs aliments ne sont pas à l’origine des espèces séparées ou isolées. Ils ont des homologues qui réagissent pour produire un sel. Si le sel est incapable de générer soit un ion basique ou acide dans l’eau, alors nous aurons une solution parfaitement neutre. Sinon, la réaction de neutralisation laissera derrière soi une solution acide ou basique (alcaline), même si elle est plus proche de pH 7 que celle non neutralisée.
(OH-), les accepteurs H + communs. Pour qu’une réaction de neutralisation soit terminée, tous les pac-men doivent être nourris. Le pacman farci est une molécule d’eau. Cependant, la réalité est un peu plus complexe que l’analogie. Les pacmen et leurs aliments ne sont pas à l’origine des espèces séparées ou isolées. Ils ont des homologues qui réagissent pour produire un sel. Si le sel est incapable de générer soit un ion basique ou acide dans l’eau, alors nous aurons une solution parfaitement neutre. Sinon, la réaction de neutralisation laissera derrière soi une solution acide ou basique (alcaline), même si elle est plus proche de pH 7 que celle non neutralisée.
La première réaction de neutralisation associée au sexe se produit dans le pénis. L’urine abandonne habituellement un résidu acide dans l’urètre, un passage partagé par les systèmes reproducteurs et excréteurs masculins. Il y a quelques acides organiques non tamponnés dans les urines qui le rendent généralement légèrement acide. Ils comprennent l’acide benzoïque, l’acide oxalique (qui provient d’oxalates en matière végétale) et l’acide acétique, qui refait surface un peu plus tard dans notre histoire. Mais les acides sont neutralisés par le fluide pré-éjaculatoire des glandes de Cowper de taille de pois, qui contient une sécrétion alcaline. Cela préserve le pH alcalin du sperme en raison de la spermine, de la spermidine et de la putrescine et de la cadaverine malodorantes. Le quartet important des amines est sécrétée par les vésicules séminales à côté de la prostate. Les spermatozoïdes sont vulnérables à l’acide parce que leurs cellules sont peu plus que des noyaux génétiques nués, et un pH faible dénature l’ADN. Lorsque le sperme contient 2 à 4 fois plus d’hydroxyde que ce qui se trouve au pH = 7 (l’eau est en équilibre avec très peu Et des quantités égales de H + et OH-), le pH du fluide vaginal varie normalement de 3,8 à 4,5. Cela protège le canal chaud et sombre de la plupart des bactéries, qui préfèrent une plage de pH de 6,5 à 7,5. Donc, le vagin ne doit jamais être lavé avec du savon, ce qui neutraliserait les acides protecteurs.
Le savon est alcalin car son ingrédient principal est un sel formé à partir de la neutralisation d’un acide gras. La partie positive de ce sel est l’ion sodium, qui est relativement inerte dans l’eau. Mais l’ion négatif neutralise H + de l’eau, ce qui provoque l’agitation de plus d’ions hydroxyde.
Lorsqu’une femme est stimulée sexuellement, les vaisseaux sanguins autour du vagin deviennent engorgés.  La pression qui en résulte sur les tissus environnants amène les parois vaginales à exhaler de minuscules gouttelettes. Leur principal ingrédient acide est l’acide acétique, également trouvé dans le vinaigre. Les gouttelettes finissent par se coalescer et leurs autres composants servent à lubrifier le canal sexuel pendant les rapports sexuels. Après l’éjaculation masculine, les bases amines du sperme protègent les spermatozoïdes en neutralisant H + proche de l’acide acétique.
La pression qui en résulte sur les tissus environnants amène les parois vaginales à exhaler de minuscules gouttelettes. Leur principal ingrédient acide est l’acide acétique, également trouvé dans le vinaigre. Les gouttelettes finissent par se coalescer et leurs autres composants servent à lubrifier le canal sexuel pendant les rapports sexuels. Après l’éjaculation masculine, les bases amines du sperme protègent les spermatozoïdes en neutralisant H + proche de l’acide acétique.
Vous l’avez là: un autre exemple de la façon dont il est impossible d’échapper à la chimie. Je dois admettre, cependant, que je n’ai pas atteint le stade où la neutralisation entre dans ma conscience alors que je faire l’amour avec mon partenaire. Je ne pense qu’à la connexion sexuelle H + -OH – au lit quand elle est endormie ou qui lève.
Selon une étude en double aveugle, impliquant vous-deviné-50 étudiants, en dehors de l’acide acétique toujours répandu, une minorité de femmes produisent également des niveaux élevés d’acides organiques mineurs tels que les acides butanoïques et propanoïques, en particulier pendant la première moitié De leurs cycles menstruels. L’acide butanoïque, également connu sous le nom d’acide butyrique, est un composant de l’odeur corporelle. La production de tous les acides dans le vagin a diminué pour les femmes qui étaient sur les contraceptifs oraux.
On pourrait être tenté d’amener d’autres collégiens à participer à une étude apparemment plus fructueuse, un  jeu de mots. Peut-être, si vous couvrez un tampon avec les enzymes nécessaires et l’alcool éthylique, il réagira avec les acides acétique et butyrique de leurs sécrétions pour produire l’acétate d’éthyle fruité et non toxique et le butyrate d’éthyle qui sent l’ananas. Problème? C’est vrai. L’élimination de l’acide entraînera des infections vaginales. Eh bien, vous pouvez toujours l’essayer sur les aisselles, en supposant que vous pouvez utiliser les enzymes.
jeu de mots. Peut-être, si vous couvrez un tampon avec les enzymes nécessaires et l’alcool éthylique, il réagira avec les acides acétique et butyrique de leurs sécrétions pour produire l’acétate d’éthyle fruité et non toxique et le butyrate d’éthyle qui sent l’ananas. Problème? C’est vrai. L’élimination de l’acide entraînera des infections vaginales. Eh bien, vous pouvez toujours l’essayer sur les aisselles, en supposant que vous pouvez utiliser les enzymes.
La matière organique dissoute (MOD ou DOM) agit comme un sensibilisateur photochimique efficace qui produit l’état de l’oxygène moléculaire monolet (O2 1Δg), un oxydant puissant qui élimine l’aniline des solutions aqueuses. Cependant, le mode exact de cette réaction, le rapport p- à o-iminobenzoquinone et la sélectivité de l’un sur l’autre restent largement spéculatifs. Cette contribution résout ces incertitudes. Nous rapportons, pour la première fois, un compte rendu mécanique et cinétique complet de l’oxydation de l’aniline avec l’oxygène du delta simple utilisant les fonctionnels B3LYP et M06 dans les phases gazeuse et aqueuse.  Les mécanismes de réaction ont été tracés aux échelles E, H et G. La 1,4-cycloaddition d’O2 1Δg à l’aniline forme un intermédiaire 1,4-peroxyde (M1), qui isomérise par un mécanisme à coque fermée pour générer une molécule de p-iminobenzoquinone. D’autre part, la réaction de type O2 1Δg ene forme un produit o-iminobenzoquinone lorsque la liaison hydroperoxylique se casse, divisant l’hydroxyle de la fraction 1,2-hydroperoxyde (M3). Le modèle en phase gazeuse prédit la formation de p- et o-iminobenzoquinones. Dans le dernier modèle, le produit d’addition M1 affiche la sélectivité jusqu’à 96%. Un modèle de solvatation de l’eau prédit que M1 se décompose davantage, en formant uniquement de la p-iminobenzoquinone avec une constante de vitesse de k = 1.85 × 109 (L/(mol s)) at T = 313 K. Ces résultats corroborent les résultats expérimentaux récents de la concentration du produit Profil dans lequel la p-iminobenzoquinonine représente le seul produit détecté.
Les mécanismes de réaction ont été tracés aux échelles E, H et G. La 1,4-cycloaddition d’O2 1Δg à l’aniline forme un intermédiaire 1,4-peroxyde (M1), qui isomérise par un mécanisme à coque fermée pour générer une molécule de p-iminobenzoquinone. D’autre part, la réaction de type O2 1Δg ene forme un produit o-iminobenzoquinone lorsque la liaison hydroperoxylique se casse, divisant l’hydroxyle de la fraction 1,2-hydroperoxyde (M3). Le modèle en phase gazeuse prédit la formation de p- et o-iminobenzoquinones. Dans le dernier modèle, le produit d’addition M1 affiche la sélectivité jusqu’à 96%. Un modèle de solvatation de l’eau prédit que M1 se décompose davantage, en formant uniquement de la p-iminobenzoquinone avec une constante de vitesse de k = 1.85 × 109 (L/(mol s)) at T = 313 K. Ces résultats corroborent les résultats expérimentaux récents de la concentration du produit Profil dans lequel la p-iminobenzoquinonine représente le seul produit détecté.
Ok ! Prix Nobel en Chimie si je parviens a résolu le problème ci dessus …
Formation de O2(1Σg+), O2(1Δg), et O2(3Σg–) pendant la désactivation de l’oxygène de nt * Triplet Phenyl Ketones: Le rôle du Transfert de charge et Sensibilisateur-Oxygène Complex Structure
Les constantes de vitesse de formation de O2(1Σg+), O2(1Δg), and O2(3Σg–) dans la trempe des états triplets T1 par O2 ont été déterminées pour une série de neuf benzophénones (BP) de potentiel d’oxydation fortement variable, Eox, Mais une énergie d’état triplet presque constante ET. Ces données sont analysées en tenant compte des données déterminées précédemment pour les sensibilisateurs T1 (ππ *) d’ET et Eox très différents. Des effets de transfert de charge (CT) beaucoup plus faible sont observés pour les BP de T1(nπ*) par rapport à ceux obtenus avec une série de biphényles structurésT1(ππ*). La trempe progresse pour les sensibilisateurs T1(nπ*) et T1(ππ*) via deux canaux différents, chacun capable de produire O2(1Σg+), O2(1Δg), and O2(3Σg–). Une chaîne provient de complexes 1,3 (T1 · 3Σ) excités sans caractère CT et l’autre de 1,3 (T1 · 3Σ) avec le caractère CT partiel. Les différentes relations d’écart d’énergie déterminent la formation des sensibilisateurs O2(1Σg+), O2(1Δg), et O2(3Σg–) de T1(ππ*) et T1(nπ*) dans le canal nCT, de sorte que la dépendance à l’excès d’énergie (ΔE) Des constantes de fréquence correspondantes est beaucoup plus faible pour les cétones T1 (nπ *). Dans le canal pCT, les constantes de vitesse respectives varient selon une échelle logarithmique linéairement avec le changement d’énergie libre pour un transfert d’électrons complet pour les sensibilisateurs T1(ππ*) et T1(nπ*). Cette dépendance est également beaucoup plus faible pour T1(nπ*) que pour les sensibilisateurs T1(ππ*). La comparaison avec la trempe induite par CT d’O2(1Δg) par des sensibilisateurs au sol révèle que les différentes configurations électroniques conduisent à différentes structures stériques de 1,3(T1(nπ*)·3Σ) et,3(T1(ππ*)·3Σ) complexes. Ces différences influencent fortement la désactivation complexe et expliquent à la fois la dépendance ΔE plus faible et les effets CT plus faibles dans la trempe de T1(nπ*) par O2.
the attachments to this post:




