Concepts généraux: Diversité des virus
Les virus sont des entités minuscules et non vivantes qui se copient une fois à l’intérieur des cellules hôtes vivantes. Tous les organismes vivants (animaux, plantes, champignons et bactéries) ont des virus qui les infectent. Typiquement, les virus sont constitués d’une couche (ou capside) qui protège sa molécule d’information (ARN ou ADN); Ces molécules d’information contiennent les empreintes bleues pour faire plus de virus. Les virus sont très divers en ce qui concerne leur forme, leur taille, leur information génétique et leur pouvoir infectieux. Les virus sont tout autour de nous, en moyenne un corps humain rencontre des milliards de particules virales chaque jour. Nos voies intestinale, respiratoire et urogénitale sont des réservoirs pour de nombreux types de virus, il est étonnant qu’avec une telle exposition constante, il y ait peu ou pas d’impact de ces organismes dans la santé humaine. Le mécanisme de défense de l’hôte est assez fort pour éliminer tout cela dans un état normal, alors qu’ils causent de nombreuses maladies méchantes seulement lorsque la personne est immunodéprimée. Bien que les virus aient une gamme limitée d’hôtes, mais parfois ils peuvent sauter la barrière des espèces et provoque des maladies mortelles, la propagation récente de la grippe porcine est un exemple idéal de ce type de propagation.
Les virus épidémiques, tels que la grippe et le syndrome respiratoire aigu sévère (SRAS), causent des maladies qui se propagent rapidement à une grande population humaine en un rien de temps et semblent attirer plus d’attention scientifique et publique que les virus endémiques qui sont continuellement présents dans un Population particulière.
La virologie comme une discipline est simplement âgée de 100 ans et la façon dont elle s’est développée dans cette petite période de temps est galopante. Le regroupement des nouveaux virus émergents dans un groupe spécifique en spécifiant certains paramètres a été initié en 1966 lors de la création du comité international sur la taxonomie des virus (ICTV) dans le but de classer les virus. L’ICTV a adopté une norme pour la description des virus. Le nom des genres, des sous-familles, des familles et des ordres doit être un seul mot, se terminant par les suffixes -virus, -virinae, -viridae et -virales respectivement. Dans l’utilisation écrite, le nom doit être en majuscule et en italique.
Les virus sont des parasites obligés, ce qui signifie leur dépendance absolue au système hôte vivant. Cette propriété du virus en a fait un outil précieux pour étudier les fonctions cellulaires et sa biologie. L’adénovirus est un exemple de virus ADN qui entre dans le noyau hôte mais qui reste séparé du génome hôte et qui, en même temps, utilise une machine de cellule hôte pour sa replication. D’autre part, la grippe est un virus à ARN qui porte sa propre enzyme pour reproduire son génome alors que les protéines virales sont synthétisées en utilisant la machine de la cellule hôte. Le virus de l’immunodéficience humaine (VIH) est un rétrovirus; Il contient de l’ARN en tant que matériel génétique, mais il se transforme en ADN après son entrée dans la cellule hôte par une enzyme appelée transcriptase inverse. Il contient également des enzymes dans son virion, à savoir l’intégrase et la protéase virale qui aident le VIH pendant le processus de maturation à l’intérieur des cellules infectées. La surface externe du virion du VIH contient deux glycoprotéines de surface appelées gp120 et gp41 qui aident à l’attachement du virus à la surface cellulaire.
Figure 2.1. Diagramme schématique du VIH

Concepts généraux: Formes de virus
Une étude précoce avec le virus de la mosaïque du tabac (TMV) a fortement suggéré que les virus étaient composés de sous-unités répétées de protéines qui ont été ultérieurement supportées par la cristallisation du TMV. Un progrès majeur dans la détermination de la morphologie du virus a été le développement de la microscopie électronique de taches négatives. Une autre modification de la microscopie électronique classique est la microscopie cryo-électronique où les échantillons contenant le virus ont été rapidement congelés et examinés à une température très basse; Cela nous permet de préserver la structure native des virus.
Un virion est une particule virale complète qui est entourée par la protéine de la capside et encapside le génome viral (ADN ou ARN). Une fois la structure sans acide nucléique peut être visible sous le microscope électronique, ces structures sont appelées capsides vides. Dans certains virus comme les paramyxovirus, l’acide nucléique est entouré par les protéines de la capside et les structures composites sont appelées nucléocapside. Certains des virus contiennent l’enveloppe lipidique qui entoure les nucléocapsides. Les enveloppes sont dérivées de la membrane de la cellule hôte pendant le processus de bourgeonnement. Comme les enveloppes sont dérivées de la membrane de la cellule hôte, elles contiennent une grande partie des protéines de surface présentes dans les cellules hôtes.
Il existe deux types de symétrie parmi les virus: icosaédriques et hélicoïdaux. En théorie, la symétrie icosaédrique peut parfois être appelée sphérique sur la base de la morphologie externe. La symétrie Icosaédrique comporte 12 sommets, 30 arêtes et 20 faces. Ils ont également une symétrie de deux, trois ou cinq fois, basée sur la rotation à travers des axes passant par leurs bords, faces et sommets respectivement (figure 3.1). Les virus de ce type ont une forme sphérique. En symétrie hélicoïdale, l’ARN génomique forme une spirale à l’intérieur du noyau des nucléocapsides (figure 3.2). Les virus de ce genre ressemblent à des rondelles ou filamenteux. Les virus qui contiennent de gros génomes d’ADN sont plus complexes en structure, par exemple les poxvirus et les herpèsvirus.
Figure 3.1. Une structure de virion icosaédrique montrant deux, trois et cinq symétries

Figure 3.2. Structure du virus à symétrie hélicoïdale.

Table 3.1. Shape of viruses belonging to different families
|
Famille |
Forme |
|
Poxviridae |
Pleomorphe |
|
Iridoviridae |
Icosahedral |
|
Asfarviridae |
Spherical |
|
Herpesviridae |
Icosahedral |
|
Adénoviridae |
Icosahedral |
|
Polyomaviridae |
Icosahedral |
|
Papillomaviridae |
Icosahedral |
|
Hepadnaviridae |
Sphérique |
|
Circoviridae |
Icosahedral |
|
Parvoviridae |
Icosahedral |
|
Retroviridae |
Spherical |
|
Reoviridae |
Icosahedral |
|
Birnaviridae |
Icosahedral |
|
Paramyxoviridae |
Pleomorphe |
|
Rhabdoviridae |
Bullet en forme |
|
Filoviridae |
Filamenteux |
|
Bornaviridae |
Sphérique |
|
Orthomyxoviridae |
Pleomorphe |
|
Bunyaviridae |
Sphérique |
|
Arenaviridae |
Sphérique |
|
Coronaviridae |
Sphérique |
|
Arteriviridae |
Sphérique |
|
Picornaviridae |
Icosahedral |
|
Caliciviridae |
Icosahedral |
|
Astroviridae |
Icosahedral |
|
Togaviridae |
Sphérique |
|
Flaviviridae |
Sphérique |
Concepts généraux: Taille du virus
Les virus sont généralement beaucoup plus petits que les bactéries et leur taille moyenne varie de 25 à 300 nm de diamètre. Ils sont visibles au microscope électronique et seuls les virus les plus grands et les plus complexes sont observés sous microscope optique à haute résolution. Les virus les plus petits appartiennent aux familles Circoviridae, Parvoviridae et Picornaviridae qui mesurent environ 20-30 nm de diamètre alors que le plus grand appartient à Poxviridae qui mesure environ 250-300 nm de diamètre. Récemment, les scientifiques ont isolé une nouvelle forme de virus qui infecte l’amibe et le regroupent sous une famille distincte Mimiviridae. Les membres de la famille Mimiviridae vont de 400 à 800 nm de diamètre.
En moyenne, une cellule bactérienne est d’environ 1400 nm de diamètre tandis qu’une cellule épithéliale moyenne est d’environ 20 000 nm. Considérant que les virus et les bactéries sont presque sphériques, une cellule bactérienne a un volume environ 30 000 fois plus grand qu’un virus alors qu’une cellule épithéliale est environ 60 millions de fois plus grande.
Tableau 4.1. Taille des virus appartenant à différentes familles
|
Family |
Size (nm) |
|
Poxviridae |
300 |
|
Iridoviridae |
135-300 |
|
Asfarviridae |
170-220 |
|
Herpesviridae |
150 |
|
Adenoviridae |
80-100 |
|
Polyomaviridae |
40-50 |
|
Papillomaviridae |
55 |
|
Hepadnaviridae |
50 |
|
Circoviridae |
12-27 |
|
Parvoviridae |
15-25 |
|
Retroviridae |
80-100 |
|
Reoviridae |
60-80 |
|
Birnaviridae |
60 |
|
Paramyxoviridae |
150-250 |
|
Rhabdoviridae |
100 |
|
Filoviridae |
80 |
|
Bornaviridae |
80-100 |
|
Orthomyxoviridae |
80-120 |
|
Bunyaviridae |
80-120 |
|
Arenaviridae |
50-280 |
|
Coronaviridae |
120-150 |
|
Arteriviridae |
60-70 |
|
Picornaviridae |
30 |
|
Caliciviridae |
30-40 |
|
Astroviridae |
30 |
|
Togaviridae |
70 |
|
Flaviviridae |
40-60 |
Concepts généraux: Composantes des génomes
En général, les virus sont constitués d’acides nucléiques (génome), de protéines (capside) et de lipides (enveloppe). Les génomes viraux peuvent être l’ADN ou l’ARN, lorsqu’une fois dans une cellule hôte, elle dirige la synthèse de nouvelles protéines virales et la réplication de nouveaux génomes viraux. Capsid est une couverture protéique qui entoure et protège le génome viral. Il est composé de nombreuses petites sous-unités appelées capsomères qui déterminent la forme du virus. L’arrangement et la composition des capsomères varie selon les familles de virus. Les enveloppes sont des membranes bicouches lipidiques dérivées de la membrane de la cellule hôte lorsque le virus sort de la membrane plasmique ou passe par un organelle lié à la membrane (comme le corps de Golgi ou le réticulum endoplasmique). L’enveloppe contient parfois de la glycoprotéine (protéine avec des hydrates de carbone) sous la forme de pointes qui les aide dans la fixation pendant le temps d’infection à la surface de la cellule hôte (gp120 dans le VIH). Dans les virus non enveloppés, les rainures présentes dans la capside et les protéines de capside spécifiques peuvent se lier au récepteur de surface cellulaire.
La caractéristique la plus importante et la plus caractéristique d’un organisme vivant est la reproduction de son information génétique. Le mécanisme de réplication du génome se fait avec plus d’économie et de simplicité parmi les différents virus. Différentes familles de virus ont leur génome constitué d’ADN double brin (ds) ou d’ADN ou d’ARN monocaténaire (ss). Les virus qui contiennent le génome de l’ARN peuvent avoir une polarité positive, négative ou mélangée (ambisense). En outre, ils ont soit des segments simples ou multiples dans leur génome avec une topologie linéaire ou circulaire. Chacun des paramètres ci-dessus ont leurs conséquences sur les voies de replication du génome viral, l’expression du gène viral et l’assemblage du virion.
Parmi les familles de virus qui infectent les animaux et les humains, celles qui contiennent le génome de l’ARN sont plus nombreuses que celles qui contiennent le génome de l’ADN. Cette disparité est encore plus grande dans le cas des virus végétaux (on ne connaît pas de virus ADN bicaténaire infectant la plante).
5.1. Les virus encodent les enzymes et suivent des voies uniques:
Presque tous les virus encodent des protéines et des enzymes uniques, de plus ils suivent des voies uniques pour transférer leur information génétique. Ce phénomène est plus prononcé dans le cas des virus ARN, soit ils utilisent une ARN polymerase ARN dépendante, soit en cas d’ADN polymerase dépendante de l’ARN du rétrovirus (VIH) pour achever leur cycle de replication. Ces deux procédés nécessitent des enzymes uniques qui sont codées par le virus suite à une infection aux cellules hôtes et sont généralement absentes ailleurs.
L’ARN polymérase ARN dépendante et la transcriptase inverse ont une capacité de relecture minimale, de sorte que leur taux d’erreur est très élevé (1 sur 10 000) par rapport à la replication de l’ADN. Cela signifie qu’une particule de virus ARN contiendra une ou plusieurs mutations à partir de son virus parental de type sauvage. La présence de nombreuses sous-espèces différentes de particules virales dans une population est également appelée quasi-espèce de virus ARN. L’activité propice aux erreurs de la polymerase du virus de l’ARN limite la limite supérieure de taille du génome au-dessus de laquelle ils ne peuvent survivre. En conséquence de ce phénomène la plupart du virus d’ARN ont leur taille de génome dans la gamme de 5-15kb (coronavirus 30kb). Le contraire est vrai dans le cas de virus d’ADN où la correction d’épreuves et l’activité de réparation d’erreur assure la réplication précise de l’ADN viral aussi grand que 800 kb. Le fait que l’ADN est plus stable chimiquement que l’ARN nous explique probablement pourquoi tous les hôtes thermophiles contiennent des virus qui ont ADNs comme leur matériel génétique.
Tableau 5.1. Nature du génome des virus appartenant à différentes familles
|
Famille |
Nature du génome |
|
Poxviridae |
dsDNA |
|
Iridoviridae |
dsDNA |
|
Asfarviridae |
dsDNA |
|
Herpesviridae |
dsDNA |
|
Adenoviridae |
dsDNA |
|
Polyomaviridae |
dsDNA |
|
Papillomaviridae |
dsDNA |
|
Hepadnaviridae |
dsDNA-RT |
|
Circoviridae |
ssDNA |
|
Parvoviridae |
ssDNA |
|
Retroviridae |
ssRNA-RT |
|
Reoviridae |
dsRNA |
|
Birnaviridae |
dsRNA |
|
Paramyxoviridae |
NssRNA |
|
Rhabdoviridae |
NssRNA |
|
Filoviridae |
NssRNA |
|
Bornaviridae |
NssRNA |
|
Orthomyxoviridae |
NssRNA |
|
Bunyaviridae |
NssRNA |
|
Arenaviridae |
NssRNA |
|
Coronaviridae |
ssRNA |
|
Arteriviridae |
ssRNA |
|
Picornaviridae |
ssRNA |
|
Caliciviridae |
ssRNA |
|
Astroviridae |
ssRNA |
|
Togaviridae |
ssRNA |
|
Flaviviridae |
ssRNA |
DsDNA = ADN bicaténaire
SsDNA = ADN monocaténaire
ARNdb = ARN bicaténaire
SsRNA = ARN monocaténaire
NssRNA = ARN monocaténaire à polarité négative
Figure 5.1. Diversité des virus appartenant à différents groupes

6.1. Isolation du virus
Les virus sont des parasites intracellulaires obligatoires qui nécessitent des cellules vivantes pour se reproduire. Généralement, la culture cellulaire, les oeufs embryonnés et les petits animaux de laboratoire sont utilisés pour l’isolement des virus. Les œufs embryonnés sont très utiles pour l’isolement de la grippe et des paramyxovirus. Bien que les animaux de laboratoire soient utiles pour isoler différents types de virus, la culture cellulaire est encore un moyen préféré pour l’isolement du virus dans de nombreux laboratoires.
Pour les cultures de cellules primaires, les fragments de tissu sont d’abord dissociés en petits morceaux à l’aide de ciseaux et l’addition de trypsine. La suspension de cellules est ensuite lavée quelques fois avec un minimum de milieu essentiel et ensemencée dans une bouteille de récipient en verre ou en plastique à fond plat après la remise en suspension avec un milieu liquide approprié et un sérum de veau f? Tal. Les cellules sont maintenues dans un incubateur à 37 ° C pendant 24 à 48 heures selon le type de cellule. Cela permet aux cellules d’attacher la surface du récipient et sa division en suivant le cycle cellulaire normal.
Les cultures cellulaires sont généralement de 3 types: –
1. Culture primaire – Ces préparations sont préparées directement à partir de tissus animaux ou humains et peuvent être subcultivées une ou deux fois seulement. Fibroblaste d’embryon de poulet.
2. Culture cellulaire diploïde – Ils sont dérivés de tissus néonatals et peuvent être sous-cultivés 5-10 fois. par exemple. Cellules de fibroblastes diploïdes humains.
3. Cellules continues – Elles sont dérivées de tissus tumoraux et peuvent être sous-cultivées plus de 10 fois. par exemple. Vero, Hep2, Hela.
Les spécimens contenant du virus doivent être transportés au laboratoire le plus tôt possible après leur prélèvement. Les tampons buccaux ou cloacaux doivent être prélevés dans des flacons contenant du milieu de transport du virus. Les fluides corporels et les tissus doivent être recueillis dans un récipient stérile et scellés correctement. Si possible, tous les échantillons doivent être maintenus et transportés à froid pour des taux de récupération plus élevés.
Dès réception, les échantillons doivent être inoculés dans une culture cellulaire en fonction de l’histoire et des symptômes de la maladie. Le flacon de culture cellulaire infecté doit être observé tous les jours pour toute présence d’effet cytopathique (CPE). Certains types d’échantillons, tels que les fèces et l’urine, sont toxiques pour les cultures cellulaires et peuvent produire un effet de type CPE. Lorsque le CPE spécifique du virus est évident, il est conseillé de faire passer le fluide de culture infecté dans une culture cellulaire fraîche. Pour les virus associés aux cellules, tels que les cytomégalovirus, il est nécessaire de trypsine et de passage des cellules infectées intactes. Des virus tels que l’adénovirus peuvent être sous-cultivés après un certain temps de congélation et de décongélation des cellules infectées.
Susceptible cell lines:
Influenza virus- MDCK cells, Vero cells.
Paramyxoviruses- DF-1 cells, Vero cells.
Adenoviruses- HEK cells, HuH7 cells.
Herpesviruses- LMH cells.
Respiratory syncytia virus- Hep2 cells, Vero cells.
Figure 6.1. Virus induced CPE in cell culture

6.2. Purification du virus et des composants:
6.2.1. Ultracentrifugation:
Les virus sont habituellement purifiés à l’aide d’ultracentrifugation. La machine est capable de faire tourner les échantillons à 20 000-100 000 tr / min sous le gradient de densité de CsCl2 ou de saccharose. La densité à laquelle les virus ne coulent ni ne flottent lorsqu’ils sont suspendus dans un gradient de densité est appelée densité flottante. La vitesse à laquelle les particules virales sédimentent sous une force gravitationnelle définie est appelée coefficient de sédimentation. L’unité de base est le Svedberg (S) qui est 10 -13 sec. La valeur S d’un virus est utilisée pour estimer sa masse moléculaire.
Types de milieu de sédimentation:
A. Coussins de saccharose ou gradient – On utilise une concentration fixe ou un gradient linéaire de saccharose. L’augmentation de la densité et de la viscosité du milieu diminue la vitesse à laquelle le virus les sédimente. En général, un «coussin» de saccharose est préparé au bas du tube de centrifugation et l’échantillon contenant le virus est superposé sur le coussin. Puisque la plupart des virus ont des densités plus grandes que le saccharose, la séparation est basée sur les valeurs de S. Cette méthode peut être utilisée pour séparer des molécules avec des valeurs S relativement proches. Parfois, le glycérol est également utilisé à la place du saccharose.
B. Centrifugation en gradient de CsCl2 – On prépare un gradient linéaire de CsCl2 dans du tampon dans le tube d’ultracentrifugation. Lorsque la concentration du CsCl2 est augmentée, la densité du milieu augmente dans le tube de sorte que la densité est faible en haut et en haut en bas. Les particules virales centrifugées à travers ce milieu formeront une bande à une position égale à leur densité flottante. Ceux-ci sont utiles pour séparer des virus de différentes densités. La limitation de cette méthode est que CsCl 2 peut inactiver de façon permanente certains virus.
6.2.2. Autres techniques de séparation:
Les virus peuvent également être séparés par électrophorèse et par Chromatographie sur colonne, mais ceux-ci ne sont pas la manière préférée de séparer le virus alors que, parfois, ils sont utilisés pour séparer des acides nucléiques ou des protéines virales. Les deux méthodes séparent le virus sur la base de la charge et / ou de la taille. Le virus contient une variété de macromolécules chargées sur sa surface qui contribue à sa mobilité électrophorétique ou ses caractéristiques d’échange d’ions. Les virus sont parfois ligaturés avec le groupe chargé à séparer par Chromatographie d’échange d’ions. La chromatographie par tamis moléculaire peut également être utilisée pour purifier les virus où de grands pores sont formés à l’aide d’agarose spécial à travers lequel des particules de virus peuvent pénétrer.
6.3. Pureté des virus:
De nombreuses méthodes sont utilisées pour évaluer la pureté du virus. Le rapport d’absorption UV à 260 et 280 nm au cours d’une analyse spectrophotométrique (260/280) est une caractéristique pour mesurer la pureté d’un échantillon de virus et dépend de la quantité d’acide nucléique et de protéine présente dans le virion. Des méthodes sérologiques telles que le dosage immuno-enzymatique (ELISA), le dosage de la précipitation radioimmunologique (RIPA), le Western blot, le test de neutralisation du virus (VNT) et la fixation du complément sont également utilisés pour vérifier la puérité d’un échantillon de virus. Ces procédés nécessitent des anticorps spécifiques de protéines virales qui peuvent être monoclonaux (un type d’anticorps spécifique d’une seule protéine virale) ou polyclonaux (plusieurs anticorps différents pouvant reconnaître plusieurs protéines virales ou epitopes). Le test de plaques est également effectué afin d’isoler la colonie unique d’un pool de virus de quasi-espèces.
Figure 6.2. Une approche générale pour purifier un virus à partir de cellules de culture tissulaire

Des questions:
Q1. Concept de la chirurgie antiseptique a été donné par
A) Alexander Fleming b) Robert Koch c) Dimitri Ivanofsky d) Joseph Lister
Q2. Le premier virus découvert
A) Coronavirus b) Virus de la mosaïque du tabac c) Flavivirus d) Poxvirus
Q3. Le premier virus animal a été découvert
A) Coronavirus b) Loeffler et Frosch c) Flavivirus d) Poxvirus
Q4. ———– Était le premier virus humain
Q5. Salk fait ———————————- vaccin en 1954.
Q6. Temin et Baltimore ont découvert l’enzyme —————.
Q7. Le syndrome respiratoire aigu sévère connu sous le nom de SRAS est causé par un ——————–.
Réponses:
1. Joseph Lister
2. Le virus de la mosaïque du tabac
3. Loeffler et Frosch
4. Le virus de la fièvre jaune
5. Le virus de la polio
6. Transcriptase inverse
7. Coronavirus
Des questions:
Q1. Les virus sont ————- parasites.
Q2.Adénovirus est un exemple de ———– virus
Q3. Influenza est un exemple de virus —————-.
Q4. Les rétrovirus contiennent ————— comme matériel génétique.
Q5. Les deux glycoprotéines de surface dans le VIH sont ————.
Q6. Selon les familles ICTV et sous-familles terminer avec le suffixe ———— et ————- respectivement.
Q7. Gp 120 et gp41 aider dans le ——————————- des virus à la surface de la cellule.
Réponses:
1. Obligation
2. ADN
3. ARN
4. ARN
5. gp 120 et gp 41
6. Viridae, virinae
7. pièce jointe
Des questions:
Q1. Deux types de symétrie dans les virus sont –
Q2.Flaviviridae a ————- forme.
Q3.Picornaviridae a ————- forme.
Q4.La symétrie isocéramique a ——— sommets, ———- bords et ————- faces
Q5.Pox et herpesvirus ont —————— comme leur matériel génétique.
Q6. Dans les virus symétrie hélicoïdale ressembler ——————.
Q7. Viruse avec symétrie icosaédrique regardez —————— en forme.
Réponses:
1. Icosaédrique et hélicoïdale.
2. Sphérique
3. Icosaèdre
4. 12, 30 et 20.
5. ADN
6. Rodlike ou filamenteux.
7. Sphérique
Des questions:
Q1. Le plus petit virus appartient à la famille _______________.
Q2. Le plus grand virus appartient à la famille _________________.
Q3. Les virus qui infectent l’amibe appartiennent à la famille —————–.
Q4.Paramyxoviridae a une taille de —————————.
Q5. Les virus sont beaucoup plus que les bactéries.
Q6. L’unité de mesure des virus est ——-.
Q7.Poxviridae a une taille de ————–.
Réponses:
1. Parvoviridae
2. Poxviridae
3. Mimiviridae
4. 150 – 250 nm
5. Plus petit
6. Nanomètre (nm)
7. 300 nm
Des questions:
Q1. Les virus sont constitués de ——-, ———– et ————.
Q2. L’ARN polymérase a une activité minimale / absente ————-.
Q3. La présence de nombreuses sous-espèces différentes de particules virales dans une population est également appelée nature ————— des virus à ARN.
Q4. Sauf la famille Coronaviridae la plupart des ————- ont leur taille de génome dans la gamme de 5-15 Kb.
Q5. Nommez trois virus à ARN simple brin de sens négatif.
Q6. Nommez trois virus à ARN à sens positif simple brin.
Q7. Nommez trois virus à ADN bicaténaire.
Réponses:
1. Génome (acides nucléiques), lipides (enveloppe) et protéines (capsides).
2. Relecture
3. Quasispecies
4. Virus ARN
5. Paramyxoviridae, Rhabdoviridae et Filoviridae
6. Coronavirus, Picornavirus et Flavivirus
7. Adénovirus, herpesvirus et Poxvirus
Des questions:
Q1. ————- est la voie préférée pour l’isolement virale à la plupart des endroits.
Q2.Three types de culture cellulaire sont ——, ———— et ——.
Q3. Nommez les trois lignées cellulaires sensibles.
Q4. Les particules virales sédimentent sous une force gravitationnelle définie appelée —————–.
Q5. ————- et ——————- sont les types de milieu de sédimentation.
Q6. Une infection virale à la cellule peut être visualisée par ———– produite par le virus.
Q7. ———————– les lignées cellulaires sont dérivées de cellules tumorales.
Q8. La vitesse à laquelle les particules virales sédimentent sous une force gravitationnelle définie est appelée —————— et ayant une unité appelée ———– —- qui est 10-13 sec.
Réponses:
1. Culture cellulaire
2. Primaire, Diploïde et Continu
3. Cellules MDCK, Vero et LMH.
4. Coefficient de sédimentation
5. Coussins de saccharose ou gradient et centrifugation à gradient de CsCl2
6. Effets cytopathiques (CPE)
7. Continu / Vero, Hep2 et Hela
8. Coefficient de sédimentation, Svedberg
Conséquences de l’infection virale chez les animaux et les humains (Partie I)
Le virus contient son matériel génétique sous forme d’acide nucléique (ADN / ARN) entouré d’une couche de protéine appelée capside. Les virus sont les parasites intracellulaires obligatoires des cellules. Cela signifie que les virus ne peuvent se reproduire qu’à l’intérieur d’une cellule hôte vivante. Le virus le fait en subvertissant les voies biosynthétiques et la capacité de synthèse de protéines de la cellule. Cela aide le virus à reproduire son acide nucléique virale, à fabriquer des protéines virales et à faciliter son échappement de la cellule parasitée.
Afin de connaître l’issue de l’infection virale sur les cellules animales, deux facteurs jouent un rôle important: la virulence du virus et la susceptibilité de l’hôte.
Virulence – Elle peut être définie comme la capacité du virus à provoquer une maladie ou, en d’autres termes, elle donne le degré relatif de pathogénicité du virus infectant. La virulence virale diffère beaucoup parmi les souches en fonction de la nature pathogène du virus. Le virus peut être classé comme pathogène ou non pathogène. La pathogénicité du virus varie de légère à sévère en fonction de la virulence des souches virales. Le terme virulence est utilisé comme mesure quantitative de sa pathogénicité. Le degré de virulence est généralement lié à la capacité du pathogène de se multiplier au sein de l’hôte et dépend d’autres facteurs tels que l’environnement de l’hôte et son état immunitaire.
7.1 Termes décrivant les infections d’un organisme
Infection lytique – Lorsque le virus pénètre dans la cellule et détourne son équipement cellulaire pour se multiplier rapidement et dans le processus tue la cellule est appelée comme une infection lytique (beaucoup de virus grippaux).
Infection lysogène – C’est le processus caractérisé par l’incorporation de l’ADN viral à l’ADN cellulaire. Une fois incorporé, l’ADN viral se réplique avec l’ADN hôte. L’ADN viral incorporé permet à la cellule hôte de subir un cycle cellulaire normal.
Infection aiguë – Il s’agit d’un début rapide des symptômes de la maladie entraînant une maladie grave ou la mort de l’animal infecté (grippe, fièvre hémorragique virale).
Infection chronique – Il s’agit d’une infection prolongée dans laquelle l’organisme n’est pas immédiatement tué et peut transporter le virus pendant une longue période (hépatite, VIH).
Termes décrivant la transmission du virus
La transmission horizontale est définie comme la transmission du virus ou d’un autre pathogène à l’hôte à n’importe quel âge après la naissance alors que la transmission verticale est le passage d’un virus de la mère au nouveau-né.
La zoonose est définie comme la maladie qui se transmet naturellement entre les animaux et l’homme (rage, virus de la grippe H1N1, virus de la fièvre de la vallée du Rift).
Parfois, le virus peut être transmis par un vecteur d’insectes (arbovirus). Les virus présents dans la salive de l’insecte infecté sont transmis lors de l’alimentation de farine de sang à l’hôte sensible.
L’infection persistante est une condition où le virus reste associé à la cellule sans la multiplier ou la tuer activement. Cela se produit souvent lorsque le génome viral est intégré dans le génome de l’hôte (retrovirus) et parfois sans intégration (Herpesvirus).
La persistance peut être classée en trois types
(1) Le génome du virus persiste dans la cellule sans libération réelle du virus, par exemple. Quelques rétrovirus.
(2) Virus libéré sporadiquement, mais reste dans un état de « latente » pour la plupart du temps (herpès simplex).
(3) Le virus est libéré en continu sans lyse de la cellule hôte, par exemple. Le virus de l’hépatite B.
Multiplicité de l’infection (m.o.i.) – C’est le rapport du virus total infecté au nombre de cellules cibles dans un état d’infection. Ceci est habituellement utilisé pour décrire l’infection d’un type cellulaire cultivé in vitro dans un système de culture.
Doses infectieuses50 (ID50) – La dose requise pour infecter 50% des animaux inoculés.
Dose létale50 (DL50) – La dose requise pour tuer 50% des animaux inoculés.
Période d’incubation – Le délai entre l’infection initiale et l’apparition réelle des symptômes de la maladie. Cette période peut aller de quelques jours (virus froid) à des années (VIH).
Figure 7.1 Diagrammes schématiques montrant les profils d’infection virale.

7.2 Entrée du virus dans l’hôte
Les virus pénètrent généralement dans le corps à travers la surface épithéliale des voies respiratoires (grippe), des voies digestives (rotavirus) et des voies génitales (VIH). Parfois, ils pénètrent à travers de petites plaies dans la peau comme les piqûres d’insectes (virus de la fièvre jaune) ou par de grandes plaies après des piqûres d’animaux (rage). Les herpèsvirus et le virus d’Epstein-Barr (EBV) sont transmis principalement par les sécrétions orales, tandis que le VIH et le virus de l’herpès simplex sont connus pour transmettre verticalement de la mère à la progéniture. La maladie causée par un virus est plus généralisée si elle pénètre à travers la paroi épithéliale du corps (oreillons, variole, rougeole, etc.).
7.3 Étapes de l’infection virale
L’infection primaire se produit lorsque le virus entre dans le corps par différents portails. Les virus entrent alors dans les flux sanguins et ciblés sur différents organes, le stade est connu comme la viremie. Après l’entrée dans le site prédilecté, ils commencent leur réplication et sont transmis à différents organes et peuvent se répandre à l’extérieur par les sécrétions corporelles, l’affection est appelée infection secondaire (infection du tissu cérébral par le virus de l’encéphalite et le foie par le virus de l’hépatite).
Figure 7.2 Représentation schématique de l’infection virale de l’entrée aux signes de la maladie.

Conséquences de l’infection virale chez les animaux et les humains (Partie II)
8.1 Maladie des voies respiratoires
Les infections respiratoires induites par le virus tuent chaque année des millions d’êtres humains et d’enfants dans le monde. La plupart des virus qui infectent seulement les voies respiratoires supérieures et inférieures n’induisent pas une forte réponse immunitaire et donc les chances de réinfection avec la même souche ou même est très commune. En moyenne, les enfants reçoivent environ 6 rhumes par an et les adultes 2-3.
Rinite (rhume) – Les signes et symptômes courants incluent une décharge nasale et une obstruction, des éternuements, une toux et un léger mal de gorge.
Pharyngite (principalement virale) – Les signes courants sont des maux de gorge, malaises, fièvre et toux. RSV et adenovirus sont les causes prédominantes chez les jeunes enfants tandis que les virus de l’herpès chez les jeunes adultes.
Laryngotracheobronchitis (Croup) – Les symptômes courants incluent la fièvre, la toux, la détresse respiratoire, obstruction parfois laryngée. Les causes les plus courantes sont la grippe et le virus parainfluenza.
Bronchiolite – Les signes et symptômes courants comprennent la respiration rapide et laborieuse, la toux persistante, la respiration sifflante, la cyanose, l’atelectasie (collapsus pulmonaire) et l’emphysème. Les principales causes sont la grippe, le parainfluenza et le VRS.
Pneumonie – se développe habituellement après une infection des voies respiratoires supérieures. Les symptômes incluent la fièvre, la toux et la difficulté à respirer. RSV, Influenza, parainfluenza et adenovirus sont les principales causes. C’est une cause majeure de décès chez les personnes âgées et les jeunes enfants. Le VRS est la principale cause de décès chez les jeunes.
8.2 Maladie du tractus gastro-intestinal
Il s’agit d’une inflammation de l’estomac et des intestins menant à la diarrhée aqueuse. La fièvre et les vomissements sont fréquents avec une gastro-entérite virale. Les maladies diarrhéiques tuent 2 millions d’enfants chaque année principalement dans les pays en développement. Les rotavirus sont la principale cause de décès. Les astrovirus et les calicivirus (virus Norwalk) peuvent également causer de la diarrhée.
8.3 Maladies du système nerveux central
Certaines infections virales peuvent causer une pathogénicité dans le cerveau et la moelle épinière (système nerveux central (SNC)). Les virus peuvent être neuro-invasifs (capables d’entrer dans le SNC après avoir traversé la barrière hémato-encéphalique) et / ou neurovirulents (peuvent endommager les cellules nerveuses). Le virus des oreillons est hautement neuro-invasif mais pas très neurovirulent alors que les herpèsvirus sont plus neurovirulents. Les virus peuvent causer des maladies de diverses manières, y compris l’infection d’une zone spécifique du cerveau ou infecter systémiquement le SNC. Parfois, leur infection provoque la lyse des neurones tandis que d’autres types d’infections peuvent provoquer la démyélinisation des axones.
Méningite – Le virus infecte les cellules méningées du SNC. Les symptômes comprennent des maux de tête, de la fièvre et de la raideur du cou avec ou sans vomissements. Les oreillons et les entérovirus sont les agents les plus courants.
Poliomyélite – La maladie implique la démyélinisation des cellules nerveuses et est plus fréquente dans les pays où le virus de la polio n’a pas été éradiqué.
Encephalitis – Les symptômes incluent la fièvre, les maux de tête, la raideur des muscles du cou, les vomissements et les déviations de l’état normal de conscience. Les patients sont souvent léthargiques et montrent des signes de convulsions. Parfois, la paralysie peut se développer avant le coma et la mort. La patience récupérée peut montrer un retard mental, l’épilepsie, la paralysie, la surdité et la cécité. De nombreux arbovirus et herpèsvirus sont associés à la forme sévère de l’encéphalite. Le syndrome de Guillain-Barré est une affection causée par une infection par le virus Epstein-Barr (EBV). Type similaire d’affection observée chez les patients infectés par la grippe ou la varicelle qui sont sous traitement à l’aspirine et se caractérisent par un œdème cérébral. La maladie est souvent mortelle et connue sous le nom de syndrome de Reye.
8.4 Maladies du système urogénital
Le virus herpès simplex et les papillomavirus sont les principaux virus qui infectent la région génitale. La transmission sexuelle est la principale façon d’acquérir ces agents. L’infection par herpèsvirus se manifeste par des démangeaisons douloureuses et des lésions vésiculaires ulcérées accompagnées parfois de fièvre et de malaises, surtout chez la femme. Les récurrences sont courantes, bien que généralement moins sévères que l’infection initiale. Certains types de VPH peuvent progresser sur plusieurs années à travers les stades de la néoplasie cervicale et le carcinome épidermoïde invasif.
8.5 Maladies virales affectant d’autres organes et systèmes
Maladies oculaires – Beaucoup de maladies virales des nourrissons peuvent impliquer la conjonctivite (Inflammation de la conjonctive qui est la membrane transparente couvrant la sclère). Il conduit à la rougeur, l’inconfort et les décharges de l’œil et est communément appelé comme l’état des yeux roses. Parfois il est également associé à la cornée (kérato-conjonctivite). Le virus herpès simplex est la forme la plus courante de virus associé à cette affection. Beaucoup d’autres types de troubles oculaires incluant la cataracte et le glaucome sont associés au virus de la rubéole et à l’infection par le cytomégalovirus.
Hépatite virale – L’inflammation du foie accompagnant les dommages des hépatocytes (cellules du foie) est appelée hépatite. Outre les virus de l’hépatite A, B, C, D, E et G qui infectent le foie en tant qu’organe principal d’autres virus peuvent également causer l’hépatite comme l’herpès et les virus de la fièvre hémorragique. Les symptômes comprennent la jaunisse (jaunissement de la peau causée par l’accumulation de bilirubine dans le sang) et les symptômes grippaux. La maladie peut devenir chronique en fonction de l’agent infectieux et conduit en fin de course à la cirrhose (fibrose du tissu hépatique).
Arthrite virale – Caractérisée par la raideur de l’articulation accompagnée de douleur, de fièvre et de myosite (inflammation des tissus musculaires). Les principaux agents pathogènes sont les flavivirus, les togavirus et les bunyavirus.
Fièvre hémorragique – Les symptômes comprennent les hémorragies généralisées du tissu épithélial incluant les yeux, les oreilles, le nez et le tractus gastro-intestinal. L’ébola, le virus de la fièvre jaune, le hantavirus, le virus de la fièvre de Lassa et le virus de Marburg sont la cause fréquente de la fièvre hémorragique virale. Les dommages sévères des organes internes sont souvent associés à la fièvre hémorragique virale. Le virus Ebola et la fièvre jaune peuvent causer de graves dommages aux hépatocytes.
Le syndrome de fatigue chronique – Il n’existe aucune preuve de ce type de virus à être associé à cette condition. La maladie est caractérisée par une fatigue extrême et est la plus fréquente suite à l’infection du CMV, de l’EBV, des entérovirus et du HTLV.
Cardite virale-myocardite – Caractérisée par une inflammation des muscles cardiaques. La maladie est souvent associée à certains entérovirus (une famille de picornavirus) tels que le virus coxsackie B. Les infections se reproduisent habituellement conduisant à des lésions myocardiques permanentes, l’agrandissement du coeur, ou l’insuffisance cardiaque congestive.
Infections virales: effet sur les macromolécules d’hôte (Partie I)
On dit qu’une cellule est permissive lorsqu’il supporte la multiplication du virus. Les virus infectant les cellules permissives sont généralement cytocides (tuer la cellule hôte) alors que l’infection à des cellules non permissives ne produit aucun effet sur une infection, donc appelée abortive. Lorsque la réplication du virus est complétée, plus d’ARNm ou de protéine virale sont produits dans les cellules infectées et sont désignés comme restreints. Dans certains cas, l’ADN viral ou l’ARN peut séquestrer indéfiniment à l’intérieur d’une cellule hôte et cette condition est appelée infection persistante.
9.1 Infections cytolytiques
Les infections cytolytiques peuvent être clairement visualisées sous un microscope optique. L’acétère de l’effet CPE est un paramètre important pour un virologiste pour identifier les espèces de virus. Dans certaines infections virales, les corps d’inclusion qui sont formés lors d’une infection virale sont identifiés après des méthodes de coloration spécifiques et sont utilisés comme outil pour identifier le virus. La tache du vendeur sert à visualiser les corps de Negri dans les cellules infectées par le virus de la rage. Les corps d’inclusion sont les restes de protéines structurales et structurales virales. En variante, les corps d’inclusion peuvent être formés par une macromolécule de cellule hôte lors d’une infection virale. Par exemple, l’infection par cytomégalovirus à une cellule modifie le cytosquelette de la cellule infectée qui sont alors visibles en tant que corps d’inclusion. L’infection virale à une cellule permissive est souvent associée à des changements dans les voies de biosynthèse cellulaire, sa morphologie et sa physiologie cellulaire.

9.1.1 Effets sur les voies de biosynthèse
L’infection par le virus à une cellule hôte inhibe son ADN et / ou son ARN et sa synthèse protéique. Parfois, cela provoque également une rupture et une fragmentation du chromosome hôte. De plus, elle modifie également les caractéristiques de croissance, la forme et l’expression de protéines de surface de la cellule hôte infectée. Les virus subissent souvent la voie de la biosynthèse de l’hôte pour leurs propres avantages au prix des macromolécules cellulaires.
L’infection par le virus à une cellule forme de nombreuses protéines précoces qui médient les changements dans les voies biochimiques cellulaires. L’acide nucléique viral contient des séquences signal spécifiques qui aident à la migration des acides nucléiques vers différents sites cellulaires. En outre, il contient également des motifs qui se lient aux régulateurs de la machine de transcription cellulaire. Par conséquent, de nombreuses protéines virales précoces contiennent des sites de liaison pour une large gamme de facteur de transcription cellulaire. Ces interactions et liaisons sont très importantes pour l’activation de la synthèse des protéines virales et la production de virus de descendance. Les événements biochimiques incluent parfois la glycosylation et la phosphorylation des protéines virales. Ces modifications sont souvent associées à l’augmentation ou à la diminution de la pathogénicité et de la virulence des virus. En général, le virus modifie les cascades impliquées dans la synthèse des protéines kinases et des messagers secondaires (AMP cyclique, GMP cyclique, etc.). Parfois, le virus déclenche les cellules pour surproduire des protéines régulatrices qui modifient les voies biochimiques cellulaires. Ces protéines régulatrices peuvent transformer les facteurs de croissance, les interleukines, les cytokines, NF-kβ ou TNFα et TNFβ (HIV et Herpesvirus). Dans certaines infections virales, l’ARNm cellulaire est dégradé (virus de la grippe). Alternativement, les herpèsvirus et les réovirus inhibent la synthèse de l’ADN cellulaire. Fait intéressant, le virus Pox dégrade l’ADN hôte avec l’aide de la DNase associée au virus.
9.1.2 Effets sur la morphologie cellulaire
Les changements évidents dans une cellule après l’infection virale sont appelés effets cytopathiques (CPE). Il existe différents types de CPE selon le type d’infection. Par exemple, le détachement de cellules de la monocouche, l’arrondi des cellules, la formation de syncytia (cellules multinucléées formées après fusion de noyaux) et la formation de corps d’inclusion nucléaire ou cytoplasmique.
Figure 9.1 Effets cytopathiques dans les cellules infectées par les virus

9.1.3 Effets sur la physiologie cellulair

9.1.4 Effet sur le chromosome de l’hôte
L’infection par le virus à une cellule conduit directement ou indirectement à l’endommagement du chromosome de la cellule hôte qui peut être létal à la cellule. Si la cellule ne meurt pas, le génome viral peut persister dans la cellule provoquant une instabilité du génome cellulaire et une altération de l’expression des protéines.
Infection virale: effet sur les macromolécules d’hôte (Partie II)
10.1 Infection persistante
Dans une infection persistante, le virus n’est pas éliminé de la cellule. Une infection persistante peut être chronique, latente et transformatrice. Dans l’infection chronique, la propagation du virus est vérifiée par le système immunitaire de l’hôte alors que dans une infection latente, seules quelques cellules expriment la protéine virale et la réplication du virus est largement limitée. En transformant les cellules infectées persistantes subit des changements génétiques qui entraînent une malignité.
Une infection persistante peut parfois causer une maladie auto-immune dans la cellule hôte. De nouveaux virus sortent de la membrane cellulaire après l’infection virale, ce qui conduit à une modification de l’antigénicité de la cellule hôte. Le système immunitaire le reconnaît comme un non-soi et produit une réponse immunitaire qui finit par causer la mort de la cellule. La réponse immunitaire provoque également la formation de complexes d’anticorps anti-antigène viral (Ag-Ab) qui peuvent être déposés dans des organes vitaux comme le cerveau et le rein. Le dépôt du complexe Ag-Ab provoque un état inflammatoire chez ces organes (néphrite et encéphalite)
10.2 Transformation de l’infection
La transformation se réfère à la capacité des cellules à se multiplier indéfiniment qui mène à
État cancéreux. La plupart des virus d’ADN comme le virus Epstein Barr et le virus du polyome peuvent provoquer une transformation dans les cellules permissives. La transformation est essentiellement orchestrée par les protéines virales qui peuvent inactiver les protéines suppresseurs de tumeur (protéines de Retinoblastome et p53) de la cellule hôte.
La transformation cellulaire implique généralement deux étapes, à savoir
1) Immortalisation et
2) Production tumorale
Figure 10.1 Liste des changements associés aux cellules transformées:

Infection virale: établissement de l’état antiviral (Partie I)
La réponse immunitaire de l’hôte à l’infection par le virus comprend des réponses immunitaires à médiation par anticorps ainsi que des réponses immunitaires à médiation cellulaire. De plus, les macrophages, les neutrophiles et les protéines du complément jouent également un rôle important dans l’élimination de l’infection virale du corps. Fait intéressant, parfois, les cellules hôtes sacrifient leur vie afin de protéger d’autres cellules et de restreindre la propagation du virus par un phénomène appelé APOPTOSE (mort cellulaire programmée). Un autre joueur très important du système immunitaire de l’hôte qui lutte contre l’invasion virale est INTERFERON.
INTERFERON:
Les interférons sont des protéines naturelles qui sont sécrétées par des cellules en réponse à des infections virales. Lorsqu’une cellule est infectée par un virus, elle libère de l’interféron qui diffuse les cellules environnantes. Après liaison aux récepteurs présents sur les cellules adjacentes ou environnantes; L’interféron stimule la production de protéines antivirales dans les cellules.
Figure 11.1 Activation de l’infection par le virus interféron après:

Les interférons sont de deux types
de type I (interféron α et β) et de type II (interféron γ). L’interféron α est produit par lymphocytes, β par fibroblaste et γ par lymphocytes T après infection virale. Le type d’interféron est moins ou plus puissant contre la classe des espèces de virus, par exemple, l’interféron α et β inhibent les virus de la stomatite vésiculeuse et de l’encéphalomyocardite mieux que l’interféron γ tandis que l’interféron γ fonctionne mieux en cas de vaccinia et d’infection par le réovirus.
Comment les interférons sont-ils produits?
En général, tous les virus peuvent induire une production d’interféron de type 1. La production de l’interféron de type 1 est plus prononcée dans le cas des virus ARN par rapport aux virus ADN. De plus, les antagonistes des lipopolisaccharides bactériens et des ARNs synthétiques sont des inducteurs connus d’interférons. En fait, le dsRNA est un puissant activateur de l’interféron. L’ARNdb induit la production d’interéféron par voie de signalisation JAK / STAT. Le récepteur 3 de type péage (TLR3) en présence d’ARNsd peut induire des interférons par une autre voie. TLR7, TLR8 et TLR9 induisent également la production d’interféron par le facteur de régulation 5 de l’interféron 5 et 7 (IRF-5 et -7). Le gène inducible à l’acide rétinoïque 1 (RIG-1) active la production d’interféron en activant IRF-3 et -7.
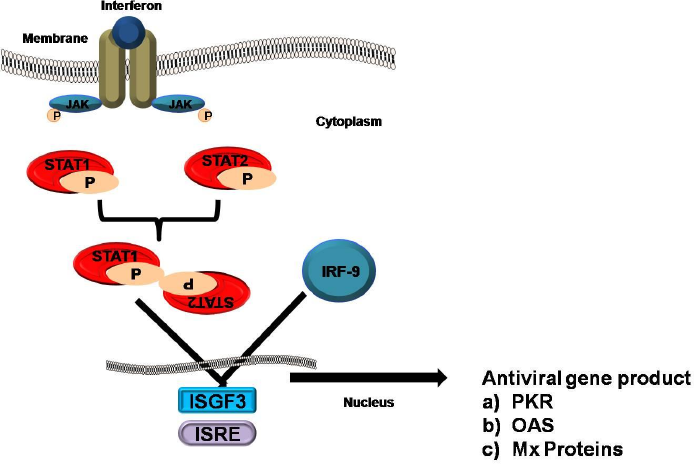
Interférons déclencheur de signal transducteur et activateur de transcription (STAT) complexes
En se coordonnant avec leurs récepteurs spécifiques. Les STATs appartiennent à la famille de ranscription
Facteurs qui contrôlent l’expression de nombreux gènes du système immunitaire. Certains STATs sont déclenchés par les interférons de type I et de type II malgré cela, chaque type d’Interferon peut également activer des STAT exclusifs. La voie de signalisation classique Janus kinase – STAT (JAK-STAT) est la voie de signalisation de cellule la plus explicite pour tous les interférons qui est également déclenchée par l’activation de STAT. La voie implique une coordination entre les JAK et les récepteurs d’interféron et la phosphorylation de STAT1 et STAT2. Par conséquent, cela conduit à la formation d’un complexe appelé facteur de gène stimulé par l’interféron 3 (ISGF3). Ce complexe comprend STAT1, STAT2 et un troisième facteur de transcription appelé IRF9. Après sa formation, le complexe se déplace à l’intérieur du noyau cellulaire où il se lie à des séquences nucléotidiques spécifiques connues sous le nom d’éléments de réponse stimulés par l’interféron (ISRE) dans les promoteurs de certains gènes spécifiques appelés ISG de gènes stimulés par l’interféron. Enfin, le regroupement d’ISGF3 et d’autres complexes de transcription déclenchés par la signalisation interféron initie la transcription des gènes responsables de la sécrétion d’interférons.

Infection virale: établissement de l’état antiviral (Partie II)
12.1 Etat antiviral activé par ARN double brin
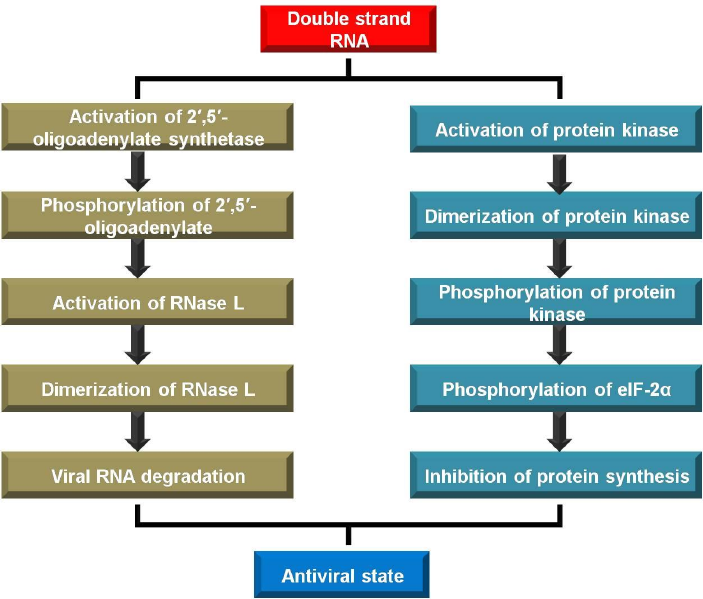
De nombreux gènes sont régulés par voie transcriptionnelle par des interférons suite à une infection par le virus. Parmi tous, trois membres ont été largement étudiés pour leurs activités antivirales.
1) protéine kinase activée par dsRNA (PKR)
2) 2 ‘, 5’- oligoadénylate synthetase (OEA)
3) protéines Mx
Figure 12.1 Schematic representation of interferon signaling for the activation of antiviral gene
Le facteur d’initiation de la traduction (EIF-2α) est le substrat le plus important
Phosphorylé par PKR. EIF-2α est inactivé suite à sa phosphorylation conduisant à l’inhibition de la synthèse des protéines virales. De cette façon, PKR présente une activité antivirale.2) 2 ‘, 5’-oligoadenylate synthetase (OAS) – OAS inducible à l’interféron est également
Activé par l’ARNdm formé lors d’une infection virale. Il se lie à RNase L déclenchant sa dimérisation et son activation. La RNase L activée dégrade l’ARNm entraînant une inhibition de la synthèse des protéines3) protéines Mx – protéine Mx induite par l’interféron ont une activité antivirale contre plusieurs virus ARN. Les souris qui expriment les protéines Mx sont plus résistantes à de nombreuses infections virales, p. grippe. Les souris déficientes en protéines PKR, RNase L et Mx se sont révélées plus sensibles aux infections virales.
12.2 Apoptose
L’apoptose (mort cellulaire programmée) est une manière intéressante explorée par la cellule hôte afin de prévenir une infection virale. Dans l’apoptose, la cellule doit mourir avant que le virus ne commence sa réplication. Au cours de l’apoptose, l’ADN cellulaire subit une fragmentation et des corps apoptotiques sont formés qui sont ensuite engloutis par des macrophages et d’autres cellules du système immunitaire. L’activation du cycle apoptotique implique la libération du « cytochrome C » des mitochondries et de l’activation en aval des caspases (cysteine-protéases aspartiques) en cascade.
12.3 Rôle du système immunitaire contre l’attaque du virus
Virus contre les mécanismes d’attaque (Partie I)
13.1 Stratégies virales pour échapper à la réponse immunitaire de l’hôte
Les adénovirus lors de l’entrée dans une cellule permissive produisent une grande quantité de petites molécules d’ARN appelées VA-1. Ce VA-1 imite l’ARNdb et se lie de manière compétitive aux protéines kinases pour inhiber la production d’interféron. Les réovirus et le virus de la vaccine produisent une protéine de liaison aux ARNsd qui inhibe l’activité de la cascade induite par l’ARNs-ARN de la production d’interféron. Le virus de l’herpès produit des analogues d’oligoadénylate 2′-5 ‘qui se lient à la RNase L et inhibent la voie d’activation en aval de la production d’interféron. Certains paramyxovirus produisent une protéine V qui est connue pour inhiber la production d’interféron en interférant à la voie de signalisation STAT. Les poxvirus produisent des récepteurs solubles connus sous le nom de récepteurs de cytokines appelants qui bloquent le récepteur de la surface cellulaire et inhibent davantage l’activation de la réponse antivirale cellulaire. En outre, de nombreux virus inhibent les voies apoptotiques pour leur survie prolongée (virus de l’herpès, adénovirus et virus de la poxvirus).

APOBEC est une enzyme d’édition d’ARNm d’apolipoprotéine B qui peut changer C à U dans un brin d’ADN. Cette mutation inhibe l’ARN polymérase pour synthétiser l’ARN viral car il ne peut pas lire U dans le brin d’ADN. L’APOBEC est une enzyme très importante codée par la cellule hôte contre l’infection par le VIH. Le VIH code une protéine appelée facteur d’infectiosité virale (Vif) qui dégrade l’APOBEC pour sa meilleure survie à l’intérieur de la cellule hôte.
L’antigène majeur Histocompatability class I (MHC-I) présent sur les macrophages est nécessaire pour présenter les antigènes viraux aux cellules immunitaires. La présentation de l’antigène viral par le MHC-I active les cellules du système immunitaire, ce qui permet d’éliminer le virus des cellules infectées (VIH et paramyxovirus).
L’ARN polymérase virale codée par de nombreux virus à l’ARN est très susceptible d’erreurs. Les virus échappent souvent au système immunitaire en incorporant graduellement la mutation dans leur génome. La variation de l’antigénicité en raison de la mutation est appelée ANTIGENIC DRIFT (VIH). Les virus qui contiennent du génome segmenté échangent souvent leurs segments de génome entre différents virus d’une même espèce et évoluent comme un nouveau virus; Le phénomène s’appelle «ANTIGENIC SHIFT» (Influenza). La dérive et le décalage antigéniques sont un moyen majeur adopté par de nombreux virus pour échapper au système immunitaire de l’hôte.
13.2 Évasion du système d’interféron par les virus
Les interférons sont bien étudiés et ont mis en place un système de défense contre l’infection virale. Néanmoins, la cohabitation entre l’hôte et les virus a entraîné l’acquisition d’un mécanisme pour inhiber le système d’interféron par la plupart des virus. Les virus inhibent l’activation de l’interféron en bloquant les différentes étapes impliquées dans la cascade de signalisation d’interféron. Certaines des stratégies uniques utilisées par les virus pour attiser le système d’interféron sont enrôlées ci-dessous
13.2.1 Inhibition de la synthèse des protéines
Beaucoup de virus détournent les machines de synthèse de protéines de l’hôte pour leurs propres avantages. Ceci conduit à une inhibition de la synthèse des protéines cellulaires et à une régulation positive de la synthèse des protéines virales. Comme les interférons sont également des protéines, l’inhibition de la synthèse des protéines hôtes par médiation virale peut aider à inhiber les interférons. L’inhibition de la traduction par la phosphorylation de eIF2α est un mécanisme antiviral médié par l’hôte, de nombreux virus ont évolué de manière à transmettre une traduction indépendante eIF2α afin d’échapper à la surveillance immunitaire.
13.2.2 Inhibition de la production d’interféron
La production d’interféron de type I est activée par l’ARNdm formé lors d’infections virales. Beaucoup de virus codent pour les protéines liant le dsRNA qui inhibent les enzymes protéines kinases et 2′-5 ‘oligoadénylate synthetase. La protéine sigma des réovirus et la protéine non structurale des virus du rotavirus et de la grippe sont des exemples de protéines liant les dsRNA.
13.2.3 Inhibition de la signalisation par interféron
Le virus de l’herpès et le papillomavirus bloquent la production d’interféron en inhibant la voie de signalisation en aval. Les adénovirus, le virus de la rougeole et les virus de l’hépatite ont également montré qu’ils inhibaient la production d’interféron. Tous les composants essentiels des voies de signalisation de l’interféron, c’est-à-dire les récepteurs d’interféron, JAK / STAT et IRF ont été impliqués dans l’inhibition du virus.
Malgré l’identification des diverses stratégies par lesquelles le virus interfère avec l’action de l’interféron, on connaît peu le mécanisme précis qui existe entre les virus et les voies d’interféron, et ses implications possibles sur la pathogénicité virale, la clairance et l’immunité virale.
Les mécanismes de contre-attaque des virus (partie II)
14.1 Réponse du virus contre l’apoptose
Le virus inhibe l’apoptose en interrompant les différentes étapes de la transcription et de la traduction. L’herpès et les poxvirus sont évolués de manière à moduler l’apoptose en bloquant l’activation des caspases. L’antigène de SV40 T et la protéine E1 d’adénovirus sont connus pour se lier avec p53 et le cibler pour une dégradation protéasomique. Bien que de nombreux virus empêchent l’apoptose, le virus de l’herpès peut provoquer sélectivement une apoptose dans les lymphocytes afin de retarder leur élimination de la cellule hôte.
14.2 Réponse du virus contre le système immunitaire de l’hôte
De nombreux virus proposent un système pour réduire l’expression des molécules MHC-I sur la surface de la cellule hôte infectée par le virus. Cela explique le rôle important du MHC-I vers l’invasion virale dans les cellules hôtes sensibles.
Le VIH, l’adénovirus et l’herpès virus inhibent la translocation du peptide dans le réticulum endoplasmique, ce qui constitue une étape nécessaire pour le chargement et le trafic du peptide sur les molécules du MHC-I. Le cytomégalovirus produit un homologue de la molécule MHC-I pour attirer le système immunitaire de l’hôte.
Le virus de l’herpès simplex exprime une « glycoprotéine E » qui se lie aux molécules d’immunoglobuline et empêche l’activation de la réponse immunitaire médiée par un anticorps.
Tableau 14.1 Inhibition de la présentation de l’antigène viral par le MHC-I

14.3 Réponse du virus contre différents facteurs hôtes
L’interférence de l’ARN est un mécanisme antiviral chez les animaux et beaucoup d’autres espèces vivantes. Beaucoup de virus codent pour les « suppresseurs d’interférences d’ARN » qui fonctionnent contre les machines d’interférence ARN hôte. Le virus de la grippe et les adénovirus ont démontré avoir cette activité.
Certains virus codent des protéines spécifiques appelées VIROCEPTORS, qui imitent les récepteurs cellulaires et agissent comme un piège pour les chimiokines et l’interféron. Poxvirus et cytomégalovirus sont connus pour coder les virocepteurs.
Tableau 14.2 Inhibition des chimiokines par les virus:
 Certains Paramyxovirus comme le virus de la maladie de Newcastle codent la protéine V qui se forme après une infection dans les cellules. Ces protéines V se lient à la protéine Helassase protéine associée à la différenciation du mélanome 5 (MDA5) dans les cellules, ce qui est un capteur pour les molécules dsRNA. Ainsi, MDA5 agit comme un antagoniste de l’interféron.
Certains Paramyxovirus comme le virus de la maladie de Newcastle codent la protéine V qui se forme après une infection dans les cellules. Ces protéines V se lient à la protéine Helassase protéine associée à la différenciation du mélanome 5 (MDA5) dans les cellules, ce qui est un capteur pour les molécules dsRNA. Ainsi, MDA5 agit comme un antagoniste de l’interféron.the attachments to this post:










